政策解讀 | 專(zhuān)利期限補(bǔ)償制度解析,以及仿制藥企業(yè)應(yīng)對(duì)策略
專(zhuān)利保護(hù)期延長(zhǎng)制度起源于1984年美國(guó)頒布的《藥品價(jià)格競(jìng)爭(zhēng)與專(zhuān)利期限補(bǔ)償法案》,也稱為《Hatch-Waxman法案》。隨后,日本、韓國(guó)、歐盟等國(guó)家也相繼建立了類(lèi)似制度,以補(bǔ)償創(chuàng)新藥上市審評(píng)審批過(guò)程占用的時(shí)間而導(dǎo)致的發(fā)明專(zhuān)利保護(hù)期損失。
專(zhuān)利的保護(hù)期限均短于專(zhuān)利期限的規(guī)定,通常情況下,我國(guó)發(fā)明專(zhuān)利權(quán)的保護(hù)期限是自申請(qǐng)日起20年。由于發(fā)明專(zhuān)利相較于實(shí)用新型專(zhuān)利和外觀設(shè)計(jì)專(zhuān)利,需要經(jīng)過(guò)實(shí)質(zhì)審查,而實(shí)際授權(quán)的日期受控于專(zhuān)利局的審查進(jìn)度,發(fā)明專(zhuān)利權(quán)的實(shí)際有效期限都不同程度的少于20年。我國(guó)近年來(lái)一直在探索專(zhuān)利保護(hù)期延長(zhǎng)制度,以補(bǔ)償在專(zhuān)利局審查或藥品上市審批過(guò)程中的不合理延遲。
2017年,我國(guó)在《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見(jiàn)》中首次提出給予適當(dāng)?shù)膶?zhuān)利期限補(bǔ)償的概念。2020年10月17日,新修正的《中華人民共和國(guó)專(zhuān)利法》(以下簡(jiǎn)稱《專(zhuān)利法》)第四十二條創(chuàng)設(shè)了我國(guó)藥品專(zhuān)利權(quán)期限補(bǔ)償制度,并于2021年6月1日正式實(shí)施。
新實(shí)施的《專(zhuān)利法》第四十二條第二款中規(guī)定,自發(fā)明專(zhuān)利申請(qǐng)日起滿四年,且自實(shí)質(zhì)審查請(qǐng)求之日起滿三年后授予發(fā)明專(zhuān)利權(quán)的,國(guó)務(wù)院專(zhuān)利行政部門(mén)應(yīng)專(zhuān)利權(quán)人的請(qǐng)求,就發(fā)明專(zhuān)利在授權(quán)過(guò)程中的不合理延遲給予專(zhuān)利權(quán)期限補(bǔ)償,但由申請(qǐng)人引起的不合理延遲除外。
第三款中規(guī)定,為補(bǔ)償新藥上市審評(píng)審批占用的時(shí)間,對(duì)在中國(guó)獲得上市許可的新藥相關(guān)發(fā)明專(zhuān)利,國(guó)務(wù)院專(zhuān)利行政部門(mén)應(yīng)專(zhuān)利權(quán)人的請(qǐng)求給予專(zhuān)利權(quán)期限補(bǔ)償。補(bǔ)償期限不超過(guò)五年,新藥批準(zhǔn)上市后總有效專(zhuān)利權(quán)期限不超過(guò)十四年。

新修訂的《專(zhuān)利法》于2021年6月1起開(kāi)始實(shí)施。此后,于2023年12月21日發(fā)布了《中華人民共和國(guó)專(zhuān)利法實(shí)施細(xì)則》(以下簡(jiǎn)稱《細(xì)則》)、《專(zhuān)利審查指南》(以下簡(jiǎn)稱《指南》)及《關(guān)于施行修改后的專(zhuān)利法及其實(shí)施細(xì)則相關(guān)審查業(yè)務(wù)處理的過(guò)渡辦法》(以下簡(jiǎn)稱《過(guò)渡辦法》)對(duì)《專(zhuān)利法》內(nèi)容進(jìn)行進(jìn)一步的補(bǔ)充,并于2024年1月20日起施行。專(zhuān)利期限補(bǔ)償制度旨在補(bǔ)償授權(quán)過(guò)程中非申請(qǐng)人原因造成的不合理延遲,對(duì)專(zhuān)利權(quán)的有效保護(hù)期限給予補(bǔ)償,保障專(zhuān)利權(quán)人的經(jīng)濟(jì)利益。
專(zhuān)利期限補(bǔ)償制度解讀

公布的《過(guò)渡辦法》第十三條規(guī)定了專(zhuān)利期限補(bǔ)償制度的適用范圍為自2021年6月1日起公告授權(quán)的發(fā)明專(zhuān)利或2021年3月1日起獲得批準(zhǔn)上市許可的新藥。此外,還規(guī)定前述請(qǐng)求的相關(guān)專(zhuān)利權(quán)在2024年1月20日前期限屆滿,國(guó)務(wù)院專(zhuān)利行政部門(mén)經(jīng)審查認(rèn)為符合補(bǔ)償條件的,作出給予期限補(bǔ)償?shù)臎Q定,補(bǔ)償期限自原專(zhuān)利權(quán)期限屆滿之日開(kāi)始計(jì)算。
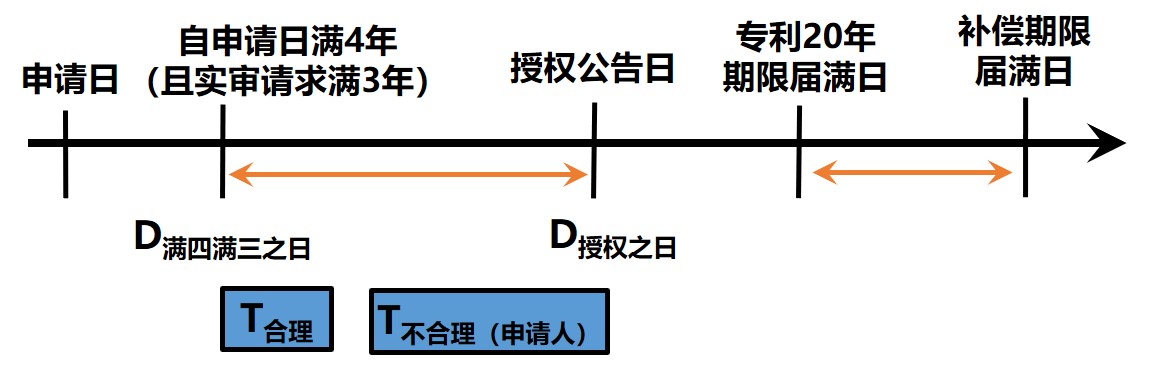
以下簡(jiǎn)單陳述《細(xì)則》對(duì)專(zhuān)利權(quán)期限補(bǔ)償制度的補(bǔ)充:
●《細(xì)則》第77條指出,請(qǐng)求給予專(zhuān)利權(quán)期限補(bǔ)償?shù)模瑢?zhuān)利權(quán)人應(yīng)當(dāng)自公告授予專(zhuān)利權(quán)之日起3個(gè)月內(nèi)向國(guó)務(wù)院專(zhuān)利行政部門(mén)提出。
●《細(xì)則》第78條指出,合理延遲包括復(fù)審程序、專(zhuān)利申請(qǐng)權(quán)屬糾紛、民事保全措施以及其它合理原因引發(fā)的延遲;
●《細(xì)則》第79條指出,申請(qǐng)人自身原因引發(fā)的延遲具體包括未及時(shí)答復(fù)通知、申請(qǐng)延遲審查、補(bǔ)交申請(qǐng)材料、請(qǐng)求恢復(fù)權(quán)利引起的延遲、申請(qǐng)人未要求提前處理引起的延遲。
●《細(xì)則》第78條指出,例外情形:同一申請(qǐng)人同日對(duì)同樣的發(fā)明創(chuàng)造既申請(qǐng)實(shí)用新型專(zhuān)利又申請(qǐng)發(fā)明專(zhuān)利,申請(qǐng)人通過(guò)聲明放棄實(shí)用新型專(zhuān)利而取得發(fā)明專(zhuān)利權(quán)的,該發(fā)明專(zhuān)利不適用專(zhuān)利期限補(bǔ)償。
專(zhuān)利權(quán)期限補(bǔ)償案例:
下面通過(guò)案例來(lái)更深入了解專(zhuān)利權(quán)期限補(bǔ)償,維得利珠單抗專(zhuān)利為國(guó)內(nèi)首批獲得專(zhuān)利權(quán)期限補(bǔ)償審批的發(fā)明專(zhuān)利,但未獲得藥品專(zhuān)利期限補(bǔ)償。
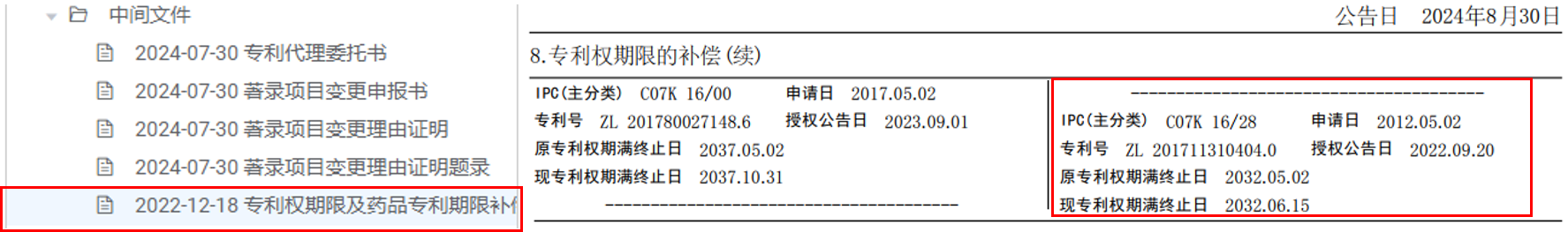
專(zhuān)利期限補(bǔ)償?shù)挠?jì)算:
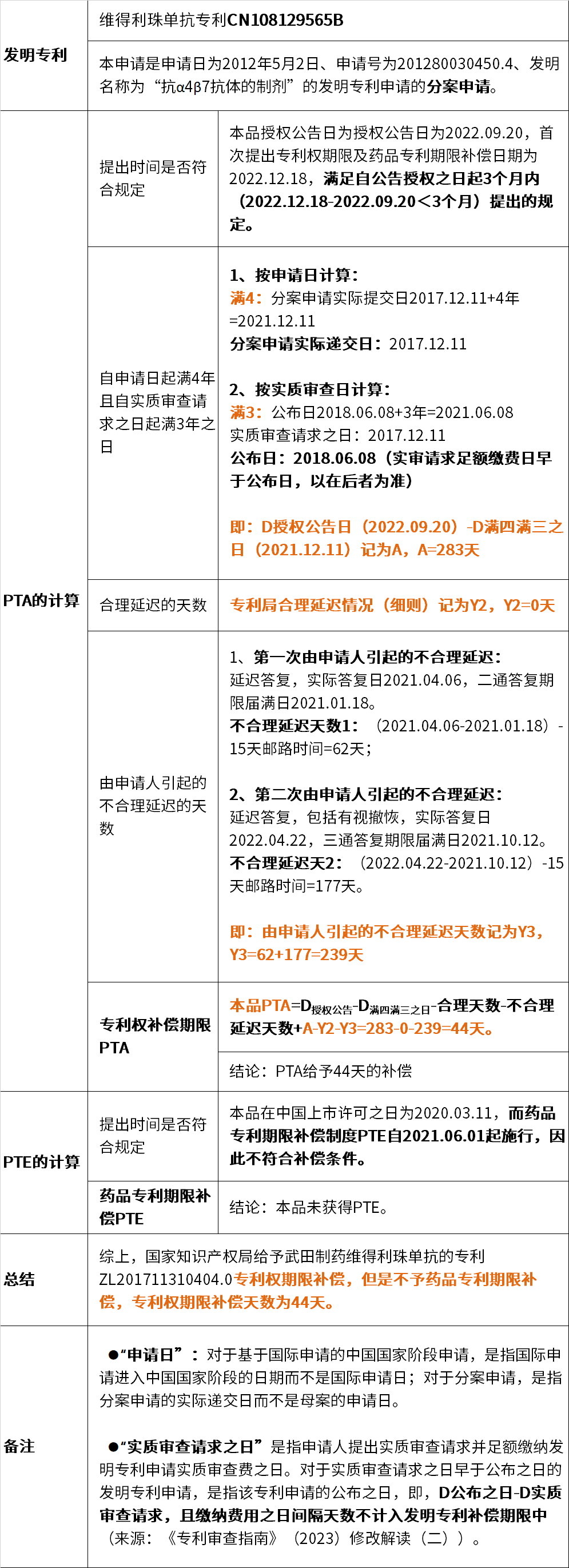
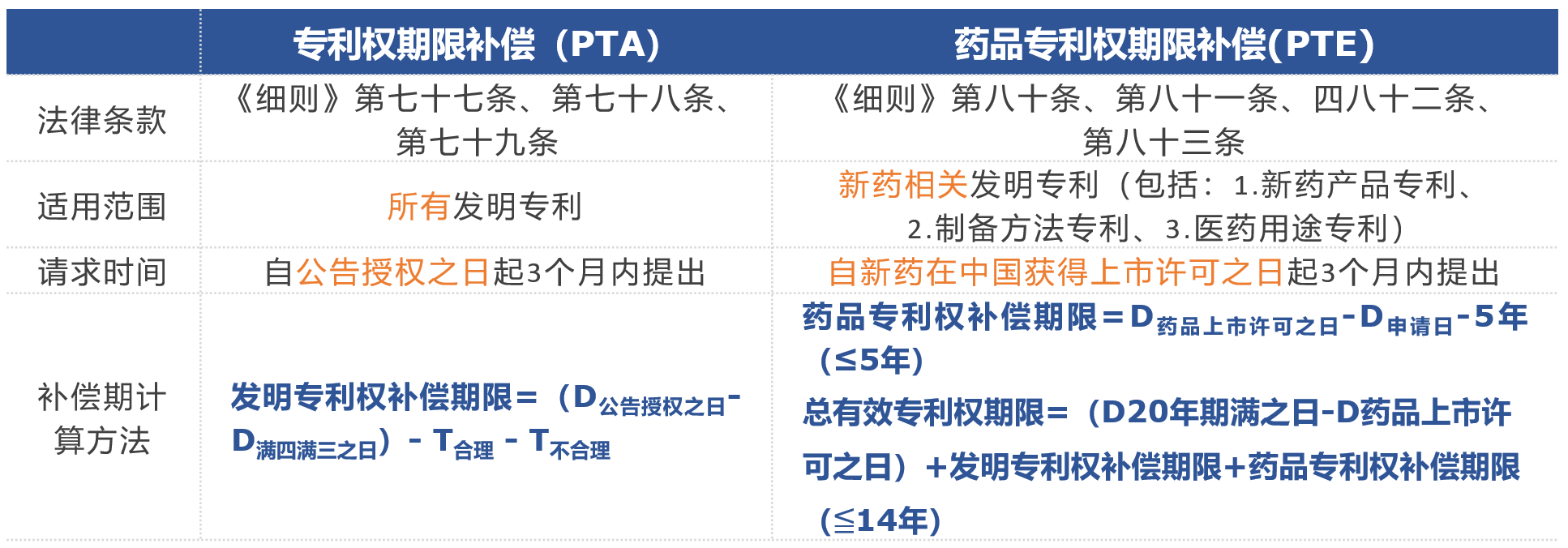
?藥品專(zhuān)利期限補(bǔ)償(PTE)
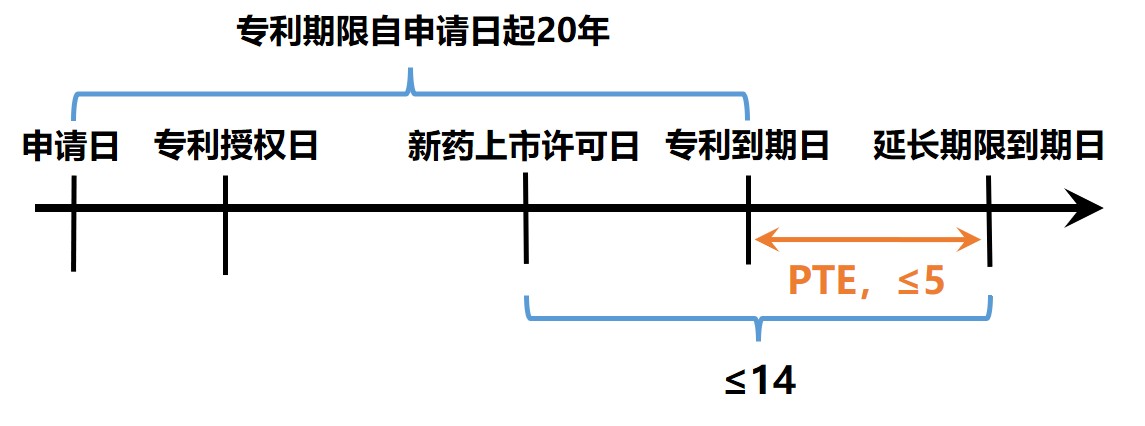
藥品專(zhuān)利權(quán)補(bǔ)償期限=D藥品上市許可之日-D申請(qǐng)日-5(≤5年);
總有效專(zhuān)利權(quán)期限=(D20年期滿之日-D藥品上市許可之日)+發(fā)明專(zhuān)利權(quán)補(bǔ)償期限+藥品專(zhuān)利權(quán)補(bǔ)償期限(≦14年)
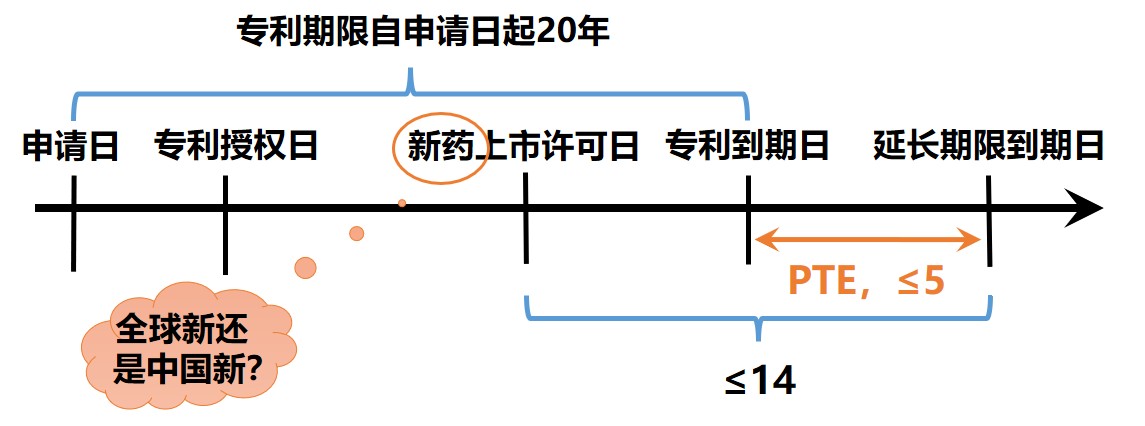
藥品專(zhuān)利期限補(bǔ)償中提到新藥上市許可日,新藥是指全球新還是中國(guó)新?
以下為《審查指南》第五部分第九章內(nèi)容:
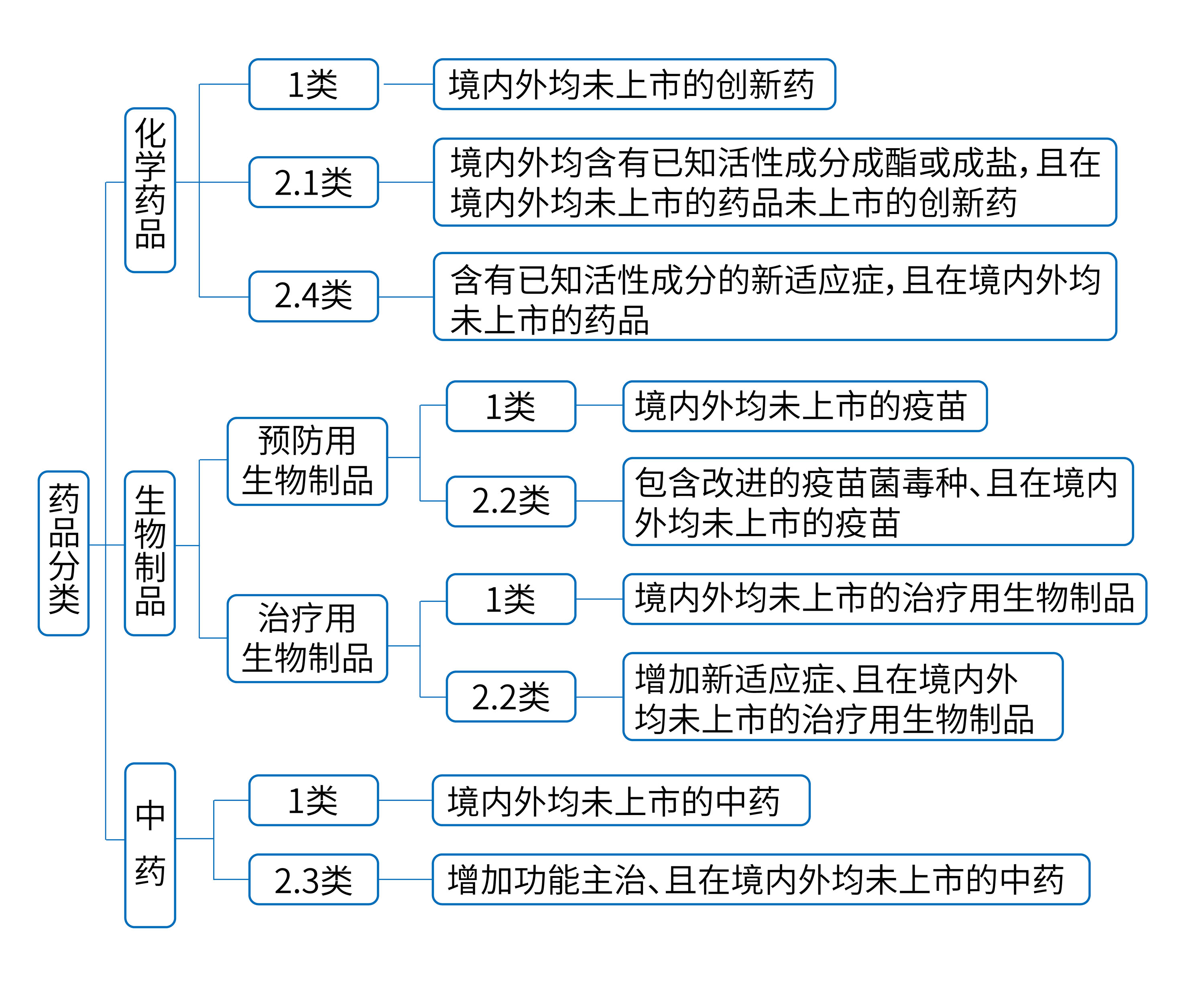
3.3 證明材料 明確記載藥品專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求時(shí),請(qǐng)求人應(yīng)當(dāng)在請(qǐng)求書(shū)中說(shuō)明的內(nèi)容包括“藥品注冊(cè)分類(lèi)”;
3.4 適用范圍 記載給予藥品專(zhuān)利權(quán)期限補(bǔ)償?shù)膰?guó)務(wù)院藥品監(jiān)督管理部門(mén)批準(zhǔn)上市的創(chuàng)新藥和符合本章規(guī)定的改良型新藥的定義,絕大概率上可以確定審查指南中所述的“創(chuàng)新藥”就是指藥品注冊(cè)分類(lèi)中的“1類(lèi)藥”,即相當(dāng)于“全球新”,這樣實(shí)際上就是把化藥2.2類(lèi)和2.3類(lèi)、化藥5.1類(lèi)及生物制品3類(lèi)中的“中國(guó)新”生物藥品排除在藥品專(zhuān)利權(quán)期限補(bǔ)償制度外。
此外,新藥專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求,除了應(yīng)當(dāng)自新藥在中國(guó)獲得上市許可之日起三個(gè)月內(nèi)向國(guó)知局提出,《指南》第五部分第九章“3.1補(bǔ)償條件”規(guī)定,請(qǐng)求藥品專(zhuān)利權(quán)期限補(bǔ)償應(yīng)當(dāng)滿足以下條件:
(1)請(qǐng)求補(bǔ)償?shù)膶?zhuān)利授權(quán)公告日應(yīng)當(dāng)早于藥品上市許可申請(qǐng)獲得批準(zhǔn)之日;
(2)提出補(bǔ)償請(qǐng)求時(shí),該專(zhuān)利權(quán)處于有效狀態(tài);
(3)該專(zhuān)利尚未獲得過(guò)藥品專(zhuān)利權(quán)期限補(bǔ)償;
(4)請(qǐng)求補(bǔ)償專(zhuān)利的權(quán)利要求包括了獲得上市許可的新藥相關(guān)技術(shù)方案;
(5)一個(gè)藥品同時(shí)存在多項(xiàng)專(zhuān)利的,專(zhuān)利權(quán)人只能請(qǐng)求對(duì)其中一項(xiàng)專(zhuān)利給予藥品專(zhuān)利權(quán)期限補(bǔ)償;
(6)一項(xiàng)專(zhuān)利同時(shí)涉及多個(gè)藥品的,只能對(duì)一個(gè)藥品就該專(zhuān)利提出藥品專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求。
藥品專(zhuān)利期限補(bǔ)償案例:
下面通過(guò)案例來(lái)更深入了解專(zhuān)利權(quán)期限補(bǔ)償,以下為國(guó)知局2024.12.27發(fā)布的獲得PTE案例。

專(zhuān)利期限補(bǔ)償?shù)挠?jì)算:

《審查指南》第五部分第九章2.3和3.7期限補(bǔ)償請(qǐng)求的審批作出如下規(guī)定,經(jīng)審查后認(rèn)為專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求符合期限補(bǔ)償條件的,均由專(zhuān)利局作出期限補(bǔ)償?shù)臎Q定,并告知期限補(bǔ)償?shù)奶鞌?shù)。

以下為《審查指南》第五章第九部分3.7期限補(bǔ)償請(qǐng)求的審批的內(nèi)容,對(duì)專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求和藥品專(zhuān)利期限補(bǔ)償先后順序做出如下規(guī)定:
經(jīng)批準(zhǔn)認(rèn)為應(yīng)當(dāng)給予藥品專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求的,如果專(zhuān)利權(quán)人已經(jīng)提出專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求但專(zhuān)利局尚未審批決定,審查員應(yīng)當(dāng)?shù)却龑?zhuān)利權(quán)期限補(bǔ)償請(qǐng)求的審批決定作出以后,再確定給予藥品專(zhuān)利權(quán)期限補(bǔ)償?shù)臅r(shí)間;如果專(zhuān)利權(quán)人尚未提出專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求,且其自專(zhuān)利授權(quán)公告之日起三個(gè)月期限尚未屆滿,審查員應(yīng)當(dāng)?shù)却龑?zhuān)利權(quán)期限補(bǔ)償請(qǐng)求的時(shí)限屆滿以后,再確定給予藥品專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求的時(shí)間,但專(zhuān)利權(quán)人明確表示放棄提出專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求除外。

為了更直觀對(duì)比專(zhuān)利權(quán)期限補(bǔ)償(PTA)和藥品專(zhuān)利權(quán)期限補(bǔ)償(PTE)的區(qū)別,列出如下表格:
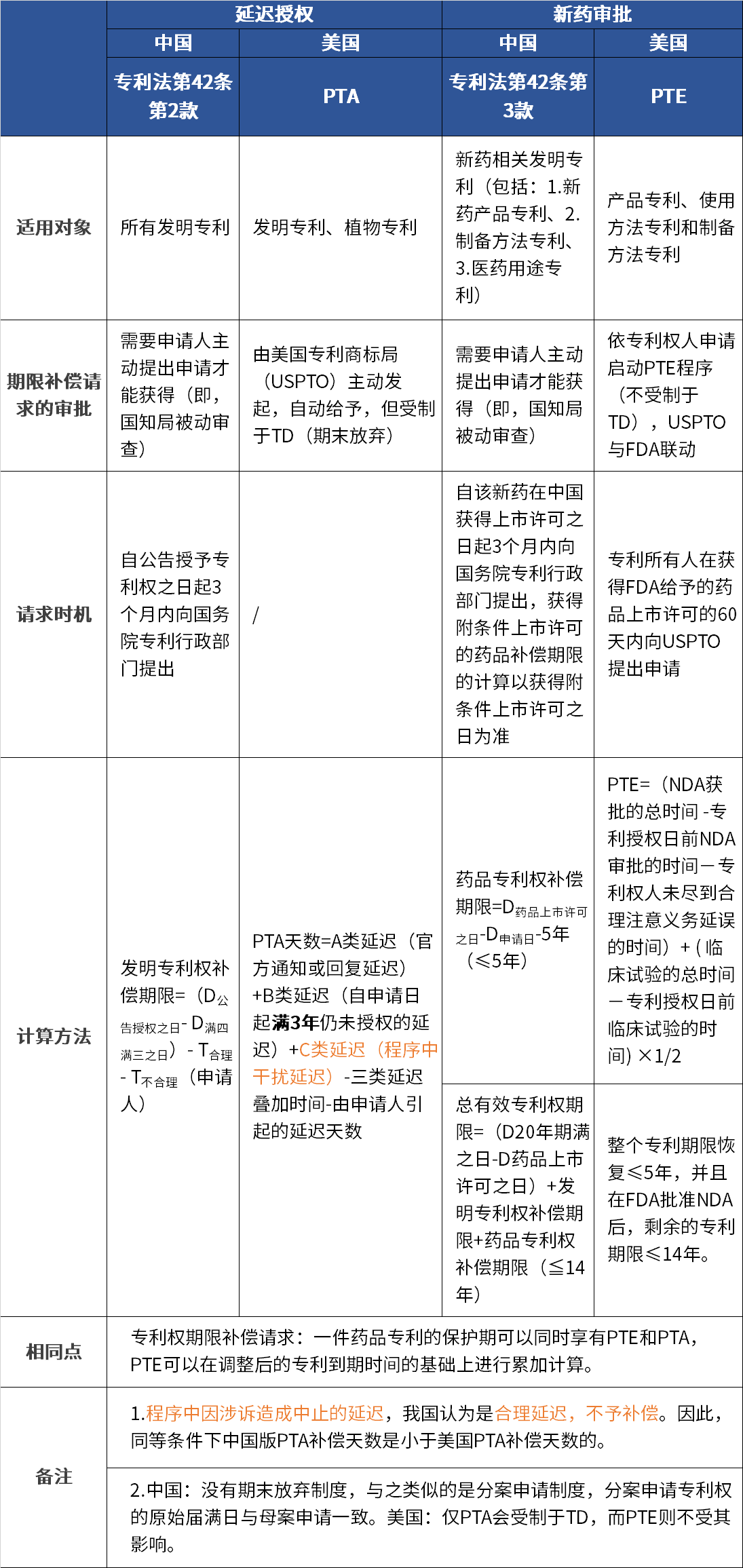
中美專(zhuān)利期限補(bǔ)償制度對(duì)比
中美日歐專(zhuān)利期限延長(zhǎng)制度淺析
● 中國(guó):藥品專(zhuān)利期限補(bǔ)償時(shí)間計(jì)算方式為在中國(guó)獲得上市許可日-專(zhuān)利申請(qǐng)日-5年(≤5年),計(jì)算公式同歐洲,但新藥批準(zhǔn)上市后總有效專(zhuān)利權(quán)期限≤14年;
● 美國(guó):PTE=臨床研究時(shí)間的1/2+注冊(cè)審批時(shí)間;整個(gè)專(zhuān)利期限恢復(fù)≤5年,并且在FDA批準(zhǔn)NDA后,剩余的專(zhuān)利期限≤14年。
● 歐洲:提出藥品補(bǔ)充保護(hù)證書(shū)(SPC)制度,SPC=首次上市許可日-基本專(zhuān)利申請(qǐng)日-5年(≤5年),首次批準(zhǔn)上市后總有效專(zhuān)利權(quán)期限≤15年。
● 日本:延長(zhǎng)時(shí)間=藥品許可之日-臨床試驗(yàn)提交之日或?qū)@跈?quán)之日(以較晚者為準(zhǔn))。
總結(jié):美國(guó)、歐洲和中國(guó)等國(guó)家還對(duì)藥品上市后的剩余專(zhuān)利期限進(jìn)行了限定,不超過(guò)14年或15年,但是日本沒(méi)有明確的限制,因此可能使得藥品在日本上市后專(zhuān)利剩余保護(hù)期限大于15年。
● 中國(guó):一個(gè)藥品同時(shí)存在多項(xiàng)專(zhuān)利的,只能請(qǐng)求對(duì)其中一項(xiàng)專(zhuān)利給予藥品專(zhuān)利期限補(bǔ)償;
● 美國(guó):對(duì)于同一個(gè)藥品上市許可,延長(zhǎng)一項(xiàng)專(zhuān)利期限的條件之一是基于該藥品上市許可沒(méi)有其他專(zhuān)利期限被延長(zhǎng);
● 歐洲:一個(gè)SPC(補(bǔ)充保護(hù)證書(shū))僅可用于一個(gè)上市許可,且一個(gè)SPC僅可用于一項(xiàng)專(zhuān)利;
● 日本:允許一項(xiàng)藥品獲得多個(gè)專(zhuān)利期限延長(zhǎng)。即,基于同一專(zhuān)利保護(hù)范圍內(nèi)的不同化合物,或同一化合物的新適應(yīng)證或新的劑型等,分別獲得上市批準(zhǔn)后,均可以基于該專(zhuān)利請(qǐng)求專(zhuān)利延長(zhǎng),即日本還允許一項(xiàng)專(zhuān)利獲得多次專(zhuān)利期限延長(zhǎng)。
總結(jié):相較于中國(guó)、美國(guó)和歐洲等國(guó)家,一項(xiàng)藥品僅允許獲得一項(xiàng)專(zhuān)利期限延長(zhǎng)的規(guī)定,日本的延長(zhǎng)制度更有利于創(chuàng)新藥的研發(fā)。
思考與展望
對(duì)于仿制藥企業(yè)而言,專(zhuān)利期限延長(zhǎng)制度必然會(huì)影響仿制藥的上市,對(duì)國(guó)內(nèi)的仿制藥企起到一定沖擊作用。
● 首先,應(yīng)持續(xù)關(guān)注創(chuàng)新藥企的專(zhuān)利期限補(bǔ)償?shù)恼?qǐng)求;
● 考慮是否可以挑戰(zhàn)國(guó)知局對(duì)專(zhuān)利期限補(bǔ)償?shù)臎Q定;
● 必要時(shí),可對(duì)創(chuàng)新藥企業(yè)的專(zhuān)利提起無(wú)效宣告請(qǐng)求。
● 若藥品受多項(xiàng)專(zhuān)利保護(hù),則只能延長(zhǎng)一項(xiàng)專(zhuān)利的期限;
● 若一項(xiàng)專(zhuān)利涵蓋多個(gè)藥品,則該專(zhuān)利只能針對(duì)一個(gè)藥品提出藥品專(zhuān)利權(quán)期限補(bǔ)償請(qǐng)求;
● 藥品專(zhuān)利權(quán)期限補(bǔ)償?shù)淖铋L(zhǎng)期限為5年,且藥品批準(zhǔn)上市后總專(zhuān)利有效期限不得超過(guò)14年等。
專(zhuān)利期限補(bǔ)償制度的提出,在一定程度上保護(hù)了創(chuàng)新藥企業(yè)的合法權(quán)益,同時(shí)也對(duì)于申請(qǐng)補(bǔ)償提出一系列限定條件,旨在平衡創(chuàng)新藥和仿制藥企業(yè)的平衡。因此無(wú)論是仿制藥企業(yè),還是創(chuàng)新藥企業(yè),均應(yīng)了解專(zhuān)利期限補(bǔ)償相關(guān)制度,更好使自己利益最大化。
-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來(lái)源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-83057670
Hotline服務(wù)熱線:010-83057670
 簡(jiǎn)體中文
簡(jiǎn)體中文

 010-83057670
010-83057670 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
